Silikon (Latin: silicium) merupakan unsur kimia yang mempunyai simbol Si
dan nomor atom 14. Ia merupakan unsur kedua paling berlimpah setelah
oksigen di dalam kerak Bumi, mencapai hampir 25.7% . Unsur kimia ini
ditemukan oleh Jons Jakob Berzelius. Terdapat dialam dalam bentuk tanah
liat, granit, kuartza dan pasir, kebanyakan dalam bentuk silikon dioksida (dikenal sebagai silika) dan dalam bentuk silikat.
Silikon
adalah polimer nonorganik yang bervariasi, dari cairan, gel, karet,
hingga sejenis plastik keras. Beberapa karakteristik khusus silikon: tak
berbau, tak berwarna, kedap air, serta tak rusak akibat bahan kimia dan proses oksidasi, tahan dalam suhu tinggi, serta tidak
dapat menghantarkan listrik.
A. Analisis Sifat-sifat Kimia dan Fisika
1. Sifat Fisika
|
Konfigurasi
|
[Ne] 3
S23P2
|
|
Fase
|
Solid
|
|
Titik leleh
|
1687 K (14100 C, 5909 0F)
|
|
Titik didih
|
3538 K (2
355 0C,
5909 0F)
|
|
|
|
|
Distribusi Elektron
|
8,2
|
|
Energi Pen
gionan, eV/atm
|
8,2
|
|
Jari-jari kovalen atom
|
790 (1,17
A0)
|
|
Jari-jari ion
|
0,41 (Si4+)
|
|
Keelektronegatifan
|
1,8
|
|
Berat atom standar
|
28,085 g.mol-1
|
|
Bahan beku
|
50,21 KJ.mol-1
|
|
Kapasitas bahan
|
(250C) 19,789 J.mol.K-1
|
|
Bahan pe
nguapan
|
359 KJ.mol
-
1
|
|
Energi ikat diri, KJ mol-1
|
210-250
|
2. Sifat Kimia
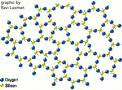
silikon
ikatan kristal dan padatan silikon
SilikSilikon murni berwujud padat seperti logam dengan titik lebur 14100C.
silikon dikulit bumi terdapat dalam berbagai bentuk silikat, yaitu
senyawa silikon dengan oksigen. Unsur ini dapat dibuat dari silikon
dioksida (SiO2) yang terdapat dalam pasir, melalui reaksi:
SiO2(
s) + 2C(s) → Si(s) + 2CO(g)
Silikon
murni berstruktur seperti Intan ( tetrahedral) sehingga sangat keras
dan tidak menghantarkan listrik, jika dicampur dengan sedikit unsur
lain, seperti alumunium (Al) atau boron (B). silikon bersifat
semikonduktor (sedikit menghantarkan listrik), yang diperlukan dalam
berbagai peralatan, elektronik, seperti kalkulator dan Komputer. Itulah
sebabnya silikon merupakan zat yang sangat penting dalam dunia modern.
Untuk itu dibutuhkan silikon yang kemurniannya sangat tinggi dan dapat
dihasilkan dengan reaksi:
SiCl4(g) + 2H2(g) → Si(s) + 4HCl(g)
Jari-jari
silikon lebih besar dari karbon, sehingga tidak dapat membentuk ikatan π
(rangkap dua atau tiga) sesamanya, hanya ikatan tunggal (σ). Karena itu
silikon tidak reaktif pada suhu kamar dan tidak bereaksi dengan asam,
tetapi dapat bereaksi dengan basa kuat seperti NaOH.
Si(s) + 4OH-(aq) → SiO4(aq) + 2H2(g)
Pada suhu tinggi, silikon dapat bereaksi dengan hidrogen membentuk hidrida, dan dengan halogen membentuk halide, seperti:
Si(s) + 2H2 → SiH4
Si(s) + 2Cl2 → SiCl4
Batuan
dan mineral yang mengandung silikon, umumnya merupakan zat padat yang
mempunyai titik tinggi, keras, yang setiap keping darinya merupakan
suatu kisi yang kontinu terdiri dari atom-atom yang terikat erat. Sebuah
contoh dari zat padat demikian, adalah silikon dioksida, yang terdapat
dialam dalam bentuk kuarsa, aqata (akik), pasir, dan seterusnya.
ikatan silikon dioksida
a. Reaksi dengan Halogen
Silikon bereaksi dengan halogen secara umum, bahkan sampai terbakar dalam gas flour (menggunakan suatu atom halogen).
Si + 2X2 → SiX4
b. Asam-oksi yang umum
Bila
dipanaskan dalam udara, unsur ini bereaksi dengan oksigen dalam reaksi
pembakaran yang sangat eksotermik untuk membentuk oksida SiO2, pada hakikatnya tidak reaktif dengan air pada suhu-suhu biasa. Namun, dua asam silikat sederhana adalah asam ortosilikat, H4SiO4, dan asam metasilikat, H2SiO3. Kedua senyawa ini praktis dan larut dalam air, tetapi mereka memang bereaksi dengan basa.
Contohnya:
H4SiO4(s) + 4 NaOH(aq) → Na4SiO4(aq) + H2O(aq)
(nartium ortosilikat)
Bila
kering seBagian (parsial) asam silikat disebut gel silika (suatu asam
yang agak mirip dengan garam buatan, NaCl). Dalam bentuk ini ia
mempunyai kapasitas menyerap yang besar terhadap uap air, belerang
dioksida, asam sitrat, benzena dan zat-zat lain, ia digunakan secara
luas sebagai bahan untuk menghilangkan kelembaban dalam wadah-wadah
kecil yang tertutup.
Garam-garam asam oksi dari kedua asam silikat tadi meliputi;
Na2SiO3 natrium metasilikat
Na4SiO4 natrium ortosilikat
Mg2SiO4 magnesium ortosilikat
LiAl(SiO3)2 litium alumunium metasilikat
Semua silikat ini kecuali silikat dari Na+, K+, Rb+, Cs+, dan NH4+, praktis tidak larut dalam air.
Semua silikat yang larut, membentuk larutan yang berasifat basa bila dilarutkan dalam air. Ion SiO32-, bertindak sebagai basa dengan menghilangkan proton dari air.
SiO32-(aq) + H2O(aq) → HSiO3-(aq) + OH-(aq)
Suatu
sifat kimia yang penting dari silikon adalah kecenderungan yang
membentuk molekul yang signifikan besar. Silikon cenderung membentuk
ikatan tunggal (masing-masing membentuk 4 dan 3 ikatan tunggal). Silikon
membentuk molekul-molekul dan ion-ion raksasa, atom oksigen membentuk
kedudukan yang berselang-seling.
B. Karakteristik silikon
Atom
silikon seperti halnya atom karbon, dapat membentuk empat ikatan secara
serentak silikon dalam susunan petrahedral, unsur Si mengkristal dengan
struktur kubus pusat muka (fcc) seperti intan, silikon bersifat semi
konduktor. Dalam siloka SiO2, setiap atom Si terikat pada
empat atom O dan tiap atom O terikat pada dua atom Si. Susunan struktur
tersebut membentuk jaringan yang sangat besar, yaitu struktur kristal
kovalen raksasa (seperti intan). Kuarsa mempunyai titik leleh tinggi dan
bersifat insulator. Kuarsa merupakan bentuk umum untuk silika namun,
sesungguhnya bentuk-bentuk silika lain banyak, sehingga umumnya disebut
mineral silika. Sebagian besar silika tidak larut dalam air. Hanya
silikat dari logam alkali yang dapat diperoleh sebagai senyawa yang
larut dalam air. Sifat umum dari mineral silikat adalah kekomplekan
anion silikatnya, namun struktur dasarnya merupakan tetrahedral
sederhana dari empat atom O disekitar atom pusat Si, tetrahedral ini
dapat berupa:
· Unit terpisah
· Bergabung menjadi rantai atau cincin dari 2,3,4 atau 6 gugus
· Bergabung membentuk rantai tunggal yang panjang atau rantai ganda
· Tersusun dalam lembaran
· Terikat menjadi kerangka tiga dimensi
SiO44-(aq) + 4H+(aq) → Si(OH)4(aq)
C. Reaktifitas silikon dan senyawanya
Kereaktifan
silikon sama halnya dengan boron dan karbon yaitu sangat tak reaktif
pada suhu biasa. Bila mereka bereaksi, tak ada kecendrungan dari
atom-atom mereka untuk kehilangan elektron-elektron terluar dan
membentuk kation sederhana, seperti B3+, C4+ dan Si4+.
Ion-ion kecil ini akan mempunyai rapatan muatan begitu tinggi, sehingga
eksistensinya tidaklah mungkin. Namun atom-atom ini biasanya bereaksi
dengan persekutuan antara elektron merekamembentuk ikatan kovalen. Bila
dipanaskan dalam udara, unsur-unsur itu bereaksi dengan oksigen dalam
reaksi pembakaran yang sangat eksotermik untuk membentuk oksida B2O3, CO2 dan SiO2,Ketiga oksida ini bersifat asam.
SiO2 pada hakikatnya tidak reaktif dengan air pada suhu-suhu biasa. Namun dua asam silikat sederhana adalah asam ortosilikat, H4SiO4 dan asam metasilikat, H2SiO3- Kedua senyawa ini praktis tak larut dalam air, tetapi mereka bereaksi dengan basa, contohnya
H4SiO4(s) + 4NaOH(aq) → Na4SiO4(aq) + 4H2O(aq)
Bila
kering sebagian (parsial), asam silikat disebut gel silika (suatu bahan
yang agak mirip dengan garam batuan, NaCl). Dalam bentuk ini, ia
mempunyai kapasitas menyerap yang besar terhadap uap air, belerang
dioksida, asam nitrat, benzena dan zat-zat lain. Ia digunakan secara
luas sebagai bahan untuk menghilangkan kelembaban dalam wadah-wadah
kecil.
D. Kegunaan silikon dan senyawa silikon
1. Penggunaan penting silikon
Penggunaan
penting dari silikon adalah dalam pembuatan transistor, chips, komputer
dan sel surya. Untuk tujuan itu diperlukan silikon ultra murni. Silikon
juga digunakan dalam berbagai jenis alise dengan besi (baja). Sedangkan
senyawa silikon digunakan dalam industri. Silica dan silikat digunakan
untuk membuat gelas, keramik, porselin dan semen.
Larutan pekat natrium silikat (Na2SiO3),
suatu zat padat amorf yang tidak berwarna, yang disebut water glass,
digunakan untuk pengawetan telur dan sebagai perekat, juga sebagai bahan
pengisi (fillir) dalam detergent.
Silikon
karbida (SiC), merupakan zat padat yang sangat keras digunakan untuk
ampelas (abrasive) dan pelindung untuk pesawat ulang alik terhadap suhu
yang tinggi sewaktu kembali kebumi. Silica gel, suatu zat padat amorf
yang sangat berfori, dibuat dengan melepas sebagian air dari asam
silikat (H2SiO3) atau (SiO2H2O). silica gel bersifat higroskopis (mengikat air) sehingga digunakan sebagai pengering dalam berbagai macam produk.
Bahan-bahan yang mengandung silikon yang dikenal baik
a. Keramik.
b. Semen
c. Kaca
d. Silikon
e. Zeolit
A. Penyalahgunaan Silikon
Di
masyarakat, kata silikon bukan lagi hal yang tabu terutama di bidang
kecantikan. Penggunaan silikon khususnya yang cair sudah di larang oleh
pemerintah sejak tahun 1970. Namun hingga kini masih saja terjadi
penyalahgunaan penyuntikan untuk tujuan mempercantik bagian tubuh
tertentu para wanita. Hal ini di lakukan karena kurangnya pengetahuan
terhadap silikon itu sendiri. Penyuntikan silikon cair tidak
mengakibatkan kematian, tetapi dapat mengakibatkan kerusakan jaringan
yang bersifat permanen. Kerusakan tersebut terjadi karena silikon cair
yang disuntikkan langsung ke dalam tubuh seperti sifat cairan umumnya
akan mencari tempat yang rendah. Sebagian silikon mungkin berkumpul di
tempat- tempat tertentu sehingga membentuk benjolan.
Silikon
bentuk cair dalam dunia medis, menurut dr. Donny V. Istiantoro dari
Jakarta Eye Center, digunakan dalam operasi retina. Retina dapat lepas
dari posisinya karena berbagai faktor, sehingga perlu dibantu
perlekatannya dengan silikon cair.






Tidak ada komentar:
Posting Komentar