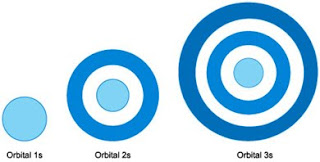
Orbital s yang berbentuk bola tidak menunjukan arah ruang tertentu karena kebolehjadian ditemukan elektron dengan bentuk ini berjarak sama jauhnya ke segala arah dari inti atom. Inti atom terdapat pada pusat bola. Perhatikanlah gambar arah ruang orbital s berikut ini
Kebolehjadian terbesar ditemukannya elektron dalam orbital s terdapat pada daerah sekitar bola, yaitu untuk orbital :
a. 1s : terdapat pada kulit bola
b. 2s : terdapat pada awan lapisan kedua
c. 3s : terdapat pada awan lapisan ketiga
Gambaran kebolehjadian ditemukan orbital pada masing-masing kulit :
a. 1s : terdapat pada kulit bola
b. 2s : terdapat pada awan lapisan kedua
c. 3s : terdapat pada awan lapisan ketiga
Gambaran kebolehjadian ditemukan orbital pada masing-masing kulit :
Subkulit
p terdiri dari tiga orbital p. Karena nilai bilangan kuantum
magnetiknya ada tiga yaitu –1, 0, dan +1. Ketiga orbital ini mempunyai
tingkat energi yang sama tetapi arah ruangnya masing-masing berbeda.
Jika digabungkan, ketiga orbital ini saling tegak lurus satu sama lain.
Bila digambarkan pada sistem koordinat kartesius yang memiliki sumbu X,
Y, dan Z maka orbital p yang terletak pada sumbu X disebut orbital px,
sedangkan yang terletak pada sumbu Y disebut orbital py. Begitu pula
halnya dengan orbital p yang terletak pada sumbu Z disebut orbital pz,
perhatikan gambar berikut ini!
Sehingga gambaran orbital p dengan bilangan kuantum azimut l =1 dinyatakan dalam gambar berikut ini!
Untuk
mengambarkan orbital atom p, ambillah 3 buah balon. Kemudian pilin
(putar) pada bagian tengah balon. Lakukan hal ini pada semua balon.
Siapkan tali pengikat yang akan digunakan untuk menggabungkan ketiga
balon. Balon pertama diletakkan tegak lurus (vertikal), sedangkan balon
kedua diletakkan mendatar (horisontal), dan balon ketiga diletakkan
diantara balon pertama dan balon kedua. Bagian balon yang dipilin harus
berada di tengah-tengah ikatan dari ketiga balon yang diikat menjadi
satu. Pastikan bahwa ketiga balon ini terikat dengan kuat.
Subkulit
d terdiri dari 5 orbital d karena nilai bil kuantum magnetiknya –2,
-1, 0, +1, +2. Seperti halnya orbital p, orbital d juga memiliki
tingkat energi yang sama tetapi arah ruangnya masing-masing berbeda.
Bila digambarkan pada sistem koordinat kartesius maka ketiga orbital d
menempati ruang antar sumbu pada koordinat kartesius tersebut.
Masing-masing orbital dinyatakan sebagai dXY, dXZ dan dYZ, sedangkan dua orbital d lainnya terletak pada sumbu koordinat kartesius yang masing-masing orbital dinyatakan sebagai dX2-Y2 dan dZ2. Bentuk kelima orbital d dapat digambarkan sebagai berikut:
Orbital dZ2 terletak pada sumbu Z
Orbital dX2-Y2 terletak pada sumbu X dan Y
Orbital dXY terletak antara sumbu X dan Y
Orbital dXZ terletak antara sumbu X dan Z
Orbital dYZ terletak antara sumbu Y dan Z
Orbital dX2-Y2 terletak pada sumbu X dan Y
Orbital dXY terletak antara sumbu X dan Y
Orbital dXZ terletak antara sumbu X dan Z
Orbital dYZ terletak antara sumbu Y dan Z
Untuk
menggambarkan orbital d yaitu : pada orbital d mempunyai 4 orbital
dengan bentuk seperti 2 balon terpilin yaitu dxy, dxz, dyz dan dx2-y2 dengan satu bentuk orbital yang berbeda yaitu orbital dz2.








Tidak ada komentar:
Posting Komentar