Soal nomor 1
Diketahui unsur 11X dapat bereaksi dengan unsur 17Y, sifat fisik senyawa yang terbentuk dan jenis ikatannya berturut-turut adalah ....
Konfigurasi elektron 11X = 2-8-1→ stabil X+
Konfigurasi elektron 17Y = 2-8-7 → stabil Y–
X+ + Y–→ XY (berikatan ionik, senyawa ion)
Sifat-sifat senyawa ion: larut dalam air, larutan dan lelehannya dapat menghantarkan arus listrik, titik lelehnya relatif tinggi.
Jawaban yang tepat A.
Soal nomor 2
Diketahui dua ion A2+ dan B- memiliki lintasan elektron sebagai berikut.
Jika unsur A mempunyai jumlah neutron 12 dan unsur B mempunyai jumlah neutron 18 pasangan data yang tepat adalah ....
Pembahasan soal nomor 2:
A2+ mempunyai 10 elektron,
A keadaan netral = 10 + 2 = 12 → Nomor atom A = 12
Konfigurasi elektron A = 2-8-2
→ golongan II-A, periode-3
Nomor massa A = jumlah netron A + nomor atom A
Nomor massa A = 12 + 12 = 24
A → golongan II-A, periode-3, 12A24
B– mempunyai 18 elektron
B keadaan netral = 18 – 1 = 17, → Nomor atom B = 17
Konfigurasi elektron B = 2-10-7
→ golongan VII-A, periode-3
Nomor massa B = jumlah netron L + nomor atom L
Nomor massa B = 18 + 17 = 35
B → golongan VII-A, periode-3, 17B35
Jawaban yang tepat D.
Soal nomor 3:
Perhatikan konfigurasi elektron unsur X dan Y berikut.
X: 1s2 2s22p6 3s23p3
Y: 1s2 2s22p6 3s23p5
Jika kedua unsur tersebut membentuk senyawa, rumus kimia dan bentuk molekul yang benar adalah
Pembahasan soal nomor 3:
X: elektron valensinya 5, X berada di periode 3, ada kemungkinan tidak mengikuti aturan oktet.
Y: elektron valensinya 7, perlu 1 elektron untuk stabil sesuai aturan oktet.
Kemungkinan pertama: A3 + B1 → AB3→ 3 pasangan elektron berikatan dan 1 pasangan elektron bebas, bentuk piramida segitiga, tidak tersedia pada opsi soal.
Kemungkinan kedua, A menggunakan 5 elektron valensinya: A5 + B1 → AB5→ 5 pasangan elektron berikatan dan tanpa pasangan elektron bebas, bentuk bipiramida segitiga, tersedia pada opsi soal.
Jawaban yang tepat D.
Soal nomor 4
Jika unsur 7A dan 17B berikatan, struktur Lewis yang benar adalah ....
Pembahasan soal nomor 4:
Yang digunakan untuk menentukan elektron valensi adalah nomor atom.
A nomor atom 7, konfigurasi elektron 2 – 5.
Elektron valensi A = 5, kurang 3 elektron untuk memenuhi aturan oktet.
B nomor atom 17, konfigurasi elektron 2 – 10 – 7.
Elektron valensi B = 7, kurang 1 elektron untuk memenuhi aturan oktet.
A3 + B1→ A1B3→ AB3→ A berikatan tunggal dengan 3B dan masih ada 1 pasang elektron bebas.
Jawaban yang tepat C.
Soal nomor 5:
Pada ruang tertutup dilakukan pembakaran 7 gram besi dengan 4 gram sulfur menghasilkan
besi sulfida sebanyak 11 gram. Kenyataan ini sesuai hukum dasar kimia, yaitu ....
A. Hukum Perbandingan Tetap (Proust)
B. Hukum Perbandingan Volume (Gay Lussac)
C. Hukum Kekekalan Massa (Lavoisier)
D. Hukum Perbandingan Berganda (Dalton)
E. Hukum Perbandingan Molekul (Avogadro)
Pembahasan soal nomor 5:
Yang kasatmata pada soal ini adalah total massa sebelum bereaksi (7 g + 4 g = 11 g) dan setelah bereaksi juga 11 g. Ini sesuai dengan hukum kekekalan massa (Hukum Lavoisier).
Jawaban yang tepat C.
Soal nomor 6:
Perhatikan data hasil uji daya hantar listrik terhadap beberapa larutan berikut!
Berdasarkan data tersebut, pasangan larutan yang memiliki derajat ionisasi = 0, ditunjukkan
pada nomor ....
Derajat ionisasi nol hanya dimiliki larutan nonelektrolit karena tidak dapat terurai. Bila dalam uji daya hantar listrik maka lampu tidak akan menyala dan tidak ada gelembung pada elektroda.
Jawaban yang tepat A.
Soal nomor 7:
Perhatikan data titrasi asam-basa asam sulfat X M dengan NaOH 0,4 M berikut!
Kadar (%) massa H2SO4 (Mr = 98) yang terdapat dalam 20 mL larutan asam sulfat tersebut jika massa jenisnya 1,8 gram/mL adalah ....
Massa H2SO4 kotor:
Massa H2SO4 = 20 mL × 1,8 g/mL = 36 g
Volume rata-rata NaOH = (24 + 23,8 + 24,2) mL : 3 = 24 mL
Jumlah mol NaOH = 24 mL × 0,4 M = 9,6 mmol.
Reaksi: 2NaOH + H2SO4→ Na2SO4 + 2H2O
Dari perbandingan koefisien reaksi setara dihitung jumlah mol H2SO4.
Jumlah mol H2SO4 = ½ jumlah mol NaOH
Jumlah mol H2SO4 = ½ × 9,6 mmol
Jumlah mol H2SO4 = 4,8 mmol = 0,0048 mol
Massa H2SO4 dari hasil titrasi:
Massa 0,0048 mol H2SO4 = 0,0048 mol × 98 g/mol
Massa 0,0048 mol H2SO4 = 0,4704 g
Kadar H2SO4 = (massa H2SO4 titrasi : massa H2SO4 kotor) × 100%
Kadar H2SO4 = (0,4704 g : 36 g) × 100%
Kadar H2SO4 = 1,30%
Jawaban yang tepat D.
Soal nomor 8:
Perhatikan gambar dua larutan berikut ini!
Pernyataan terkait kedua larutan tersebut, antara lain:
A. 1 dan 3
B. 1 dan 5
C. 2 dan 4
D. 2 dan 5
E. 3 dan 5
Pembahasan soal nomor 8:
pH HCl = -log(10–3) = 3
pH CH3COOH = -log(√(10–1.10–5) = -log(10–3) = 3
Jadi kedua larutan memiliki pH sama, [H+] juga sama.
HCl merupakan asam kuat (terurai sempurna) dan CH3COOH merupakan asam lemah (terurai sebagian), bila diuji dengan lakmus merah tidak akan berubah warna. Penjelasan yang benar (1), (3)
Jawaban yang tepat A.
Soal nomor 9:
Diketahui campuran larutan penyangga sebagai berikut.
Jika Ka CH3COOH = 10-5, maka urutan pH dimulai dari yang terkecil adalah ....
[H+] = Ka(mol asam lemah)/(mol basa konjugat)
(1) [H+] = 10–5.(5 mmol/5 mmol) = 10–5 M
(2) [H+] = 10–5.(5 mmol/10 mmol) = 5 ×10–6 M
(3) [H+] bukan campuran larutan penyangga, tidak CN– bukanlah basa konjugat dari CH3COOH.
pH berbanding terbalik dengan [H+], semakin besar [H+] maka pH semakin kecil.
Jadi urutan yang benar adalah (1), (2)
Jawaban yang tepat TIDAK TERSEDIA.
Soal nomor 10
Bacalah wacana berikut ini.
pH normal darah manusia adalah dirancang selalu relatif tetap, yaitu 7,4 ± 0,05. Komponen utama buffer darah adalah H2CO3 dan HCO3- dengan perbandingan 1:20, yang merupakan salah satu hasil metabolisme pernafasan.
CO2(g) ⇌ CO2(aq)
CO2(aq) + H2O(l) ⇌H2CO3(aq)
H2CO3(aq) + H2O(l) ⇌ H3O+(aq) + HCO3-
Pada kasus alkalosis atau kelebihan basa yang disebabkan kekurangan CO2 terlarut, pH darah naik hingga mencapai 7,8. Jika dibiarkan akan menyebabkan kerusakan sistem syaraf. Salah satu upaya mengembalikan pH normal darah adalah dengan pemberian masker gas oksigen didukung infus larutan buffer bikarbonat pH 6,7 selama selang waktu tertentu. (Ka H2CO3 = 4,3 x 10-7).
Berdasarkan wacana tersebut, pemberian larutan bikarbonat pH 6,7 bertujuan untuk ….
Kasusnya adalah alkolisis atau kelebihan basa dengan pH di atas 7,4. Tujuan utamanya adalah menurunkan pH darah agar normal. Menambah NaHCO3 (atau HCO3–) dengan pH 6,7 berarti meningkatkan konsentrasi H2CO3 yang berada di ruas kiri. Bila menambah konsentrasi zat di ruas kiri maka kesetimbangan akan bergeser ke kanan, terbentuk lebih banyak H3O+ hingga pH normal kembali.
Jawaban yang tepat E.
Soal nomor 11:
Perhatikan tabel persamaan reaksi hidrolisis garam berikut ini!
Pasangan data garam terhidrolisis yang tepat adalah ....
Pasangan data untuk garam hidrolisis yang tepat adalah (1) dan (3)
Hidrolisis basa konjugat dari asam lemah akan menghasilkan [OH–] sehingga sifat larutan akan basa dan pH > 7.
Hidrolisis asam konjugat dari basa lemah akan menghasilkan [H3O+] sehingga sifat larutan akan asam dan pH < 7.
Jawaban yang tepat B.
Soal nomor 12:
Diketahui data beberapa indikator dan trayek pH.
Berikut ini adalah kurva titrasi asam-basa.
Pasangan asam-basa/basa-asam dan indikator yang digunakan adalah ....
Prinsip umum untuk titrasi:
Titrasi asam kuat ke basa kuat titik ekivalennya sama dengan 7.
Titrasi asam kuat ke basa lemah titik ekivalennya biasa di bawah 7
Titrasi basa kuat ke asam lemah titik ekivalennya biasa di atas 7
A-B-E jelas tidak tepat.
Pilihan D sepertinya juga tidak mungkin benar sebab pH basa lemah biasa tidak jauh di atas 7.
Pada soal ini skala pH tidak proporsional, ini dapat dilihat jarak pH 4 ke 5,8 dibanding 5,8 ke pH 11. Kalau pun mau memilih C agak mendekati kebenaran walau berdasar rentang pH indikator menjadi keliru juga.
Jawaban yang tepat TIDAK ADA JAWABAN YANG TEPAT.
Soal nomor 13:
Diketahui Ksp Mg(OH)2 = 6 × 10-12. Dua buah larutan dicampur dengan komposisi sebagai berikut.
Pasangan campuran yang menghasilkan endapan Mg(OH)2 ditunjukkan pada nomor ....
Syarat terbentuknya endapan nilai Qc > Ksp
Qsp Mg(OH)2 = [Mg2+][OH–]2
(1) → 10–3 × (10–5)2 = 10–3 × 10–10 = 10–13
(2) → 10–4 × (10–3)2 = 10–4 × 10–6 = 10–10
(3) → 10–5 × (10–4)2 = 10–5 × 10–8 = 10–13
(4) → 10–3 × (10–3)2 = 10–3 × 10–6 = 10–9
(5) → 10–5 × (10–5)2 = 10–5 × 10–10 = 10–15
Qc Mg(OH)2 yang nilainya lebih besar dari 6×10–12 (Ksp Mg(OH)2) adalah (2) dan (4)
Jawaban yang tepat TIDAK TERSEDIA (semestinya D tetapi harus Qc > Ksp)
Soal nomor 14:
Jika kita memasukkan bongkahan batu kapur ke dalam air, akan terjadi gelembung-gelembung gas dan wadah akan terasa panas.
Pernyataan yang benar dari data percobaan tersebut adalah ….
Ketika wadah panas tentu dari reaksi batu kapur dalam air (sebagai sistem) yang memang melepaskan panas/kalor. Terjadi perpindahan panas dari sistem ke lingkungan.
Jawaban yang tepat C.
Soal nomor 15:
Diketahui data percobaan reaksi 2A + B2 → 2AB
Grafik yang menunjukkan orde reaksi dari A adalah ....
Pembahasan soal nomor 15:
Penentuan orde reaksi terhadap A.
Pilih data 2 dan 1, untuk menentukan orde reaksi dari A, karena konsentrasi B tetap (sama)
([A2]/[A1])n = v2/v1
(2a/a)n = 64/16
2n = 4
2n = 22
n = 2
Karena orde terhadap A adalah 2 maka grafik yang sesuai adalah grafik pada pilihan C
Jawaban yang tepat C.
Soal nomor 16:
Ke dalam 4 gelas kimia yang masing-masing berisi 20 mL asam sulfat dimasukkan 4 gram
logam seng seperti pada gambar berikut!
Kondisi yang diharapkan:
- Variabel bebas: luas permukaan sentuh
- Variabel terikat: laju/waktu
- Variabel terkontrol: [H2SO4]
Pasangan gambar yang sesuai dengan kondisi tersebut adalah ....
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan soal nomor 16:
Bila variabel bebasnya adalah luas permukaan sentuh, maka variabel luas permukaan harus dibuat beda.
Bila variabel terikatnya adalah waktu/laju, besarnya waktu akan ditentukan berdasar luas permukaan sentuh yang dibuat berbeda.
Bila variabel kontrolnya [H2SO4], maka konsentrasi pasangan harus tetap agar dapat digunakan melihat efek perubahan luas permukaan sentuh yang merupakan variabel bebas.
Di antara gambar yang luas permukaan sentuhnya berbeda hanyalah (2), artinya gambar (2) ini akan berpasangan dengan gambar lain. Bila tidak ada nomor (2) pada pasangan sudah pasti salah.
Bila dipasangkan (1) dan (2). Variabel lain semua tetap/sama, hanya luar permukaan sentuh yang berbeda, ini pilihan tepat.
Bila dipasangkan (2) dan (3) maka variabel bebasnya ada dua, yaitu luas permukaan sentuh dan konsentrasi H2SO4, ini jadi tidak tepat.
Bila dipasangkan (2) dan (4) maka variabel bebasnya ada dua, yaitu luas permukaan dan suhu, ini jadi tidak tepat.
Jawaban yang tepat A.
Soal nomor 17:
Bacalah informasi berikut!
Di negara yang memiliki musim dingin, proses pencairan es yang terdapat di jalan-jalan dan
trotoar dilakukan dengan menaburkan garam ke hamparan salju.
Sifat koligatif larutan yang paling tepat berhubungan dengan fenomena wacana di atas adalah ....
A. Penurunan tekanan uap
B. Kenaikkan titik didih
C. Penurunan titik beku
D. Tekanan osmosis
E. Kenaikkan tekanan uap
Pembahasan soal nomor 17:
Penentuan orde reaksi terhadap A.
Salju (air beku) diberi garam agar pada suhu rendah salju dapat mencair, tidak beku. Dengan diberi garam yang relatif mudah larut maka terjadi penurunan titik beku air, sehingga ketika suhu nol derajat ia tidak beku.
Jawaban yang tepat C.
Soal nomor 18:
Proses pembuatan gas NO2 sesuai dengan reaksi:
2NO(g) + O2(g) ⇌ 2NO2(g)
Diperoleh data sebagai berikut:
Jika suhu dinaikkan pada tekanan tetap, ternyata harga Kp turun menjadi
1/9 kalinya, sedangkan jika suhu diturunkan kembali, harga Kp akan
kembali naik. Pemyataan yang tepat
mengenai hal tersebut adalah ….
Dari tabel diketahui nilai Kp yang semakin kecil berarti tekanan parsial produk (NO2) berkurang dan tekanan parsial pereaksi (NO dan O2) bertambah ketika suhu dinaikkan dari 600 oC ke 1000 oC. Tekanan parsial berkurang sebanding dengan berkurangnya jumlah atau konsentrasi produk. Terjadi pergeseran dari kanan ke kiri, ketika suhu dinaikkan. Ini merupakan ciri reaksi eksoterm ke arah produk, jika suhu dinaikkan maka reaksi akan bergeser ke arah pereaksi (di kiri).
Pada reaksi eksoterm jika suhu diturunkan maka konsentrasi produk akan meningkat (kesetimbangan bergeser ke kanan) yang berati tekanan parsialnya juga bertambah dan konsentrasi pereaksi berkurang atau tekanan parsial pereaksi berkurang.
Jawaban yang tepat TIDAK TERSEDIA.
Soal nomor 19:
Bacalah informasi berikut!
Apabila seseorang memerlukan injeksi cairan nutrisi/infus, cairan infus tersebut harus bersifat isotonik dengan cairan dalam darah. Injeksi cairan,nutrisi/infus (NaCl, Mr NaCl = 58,5) harus isotonik dengan cairan dalam darah, berkisar 9,84 atm pada suhu ruangan 27oC. Apabila seseorang memerlukan 1 liter cairan infus, massa NaCl yang dibutuhkan adalah …. (R = 0,082 L.atm/mol.K)
Tekanan osmotik larutan NaCl = tekanan cairan dalam darah.
Tekanan osmotik larutan NaCl = 9,84 atm.
9,84 atm = [NaCl] × R × T
9,84 atm = [NaCl] × 0,082 L.atm/(mol.K) × (27 + 273) K
9,84 atm = [NaCl] × 24,6 L.atm/mol
[NaCl] = 9,84 atm : 24,6 L.atm/mol
[NaCl] = 0,4 mol/L
Untuk setiap 1 L larutan = 0,4 mol NaCl
Massa NaCl = 0,4 mol × 58,5 g/mol
Massa NaCl = 23,4 g
Jawaban yang tepat D.
Soal nomor 20:
Perhatikan wacana berikut ini.
Senyawa aktif pada pemutih adalah senyawa natrium hipoklorit (NaClO). Untuk menghitung kadar NaClO dalam pemutih digunakan reaksi iodometri sebagai berikut.
NaClO(l) + KI(l) + 2HCl(aq) → NaCl(aq) + 2KCl(aq) + I2(l) + H2O(l)
I2(l) + 2Na2S2O3(aq) → 2NaI(aq) + Na2S2O6(aq)
Berdasarkan wacana tersebut, sifat kimia senyawa yang terdapat di dalam pemutih adalah ....
Fokus hanya pada zat pemutih. Pemutih (NaClO) pada reaksi pertama mengalami reaksi reduksi. Tepatnya bilangan oksidasi Cl pada NaClO berubah dari +1 menjadi –1 pada Cl– (dalam NaCl atau KCl). Karena ia mengalami reaksi reduksi maka ia berperan sebagai oksidator.
Jawaban yang tepat D.
Soal nomor 21:
Perhatikan wacana berikut ini.
Sendok logam yang terbuat dari zink akan disepuh dengan logam tembaga seperti gambar berikut.
Reaksi yang terjadi di katoda adalah ....
Di katode akan terjadi reduksi kation. Kation dalam larutan adalah Cu2+.
Jadi reaksi di katoda: Cu2+(aq) + 2e–→ Cu(s)
Jawaban yang tepat A.
Soal nomor 22:
Diketahui notase sel Volta: Mg|Mg2+||Sn2+|Sn Eo = 2,23 V. Gambar sel Volta yang benar adalah ....
Pembahasan soal nomor 22:
Mg(s) | Mg2+aq) || Sn2+ (aq) | Sn(s) E0 = +2,23 Volt
Makna dari notasi sel:
Mg berperan sebagai anoda, Mg akan melarut atau teroksidasi menjadi Mg2+ dan Sn berperan sebagai katoda, di sini akan terjadi reduksi S2+ menjadi Sn.
Gambar yang sesuai dengan notasi sel adalah A, B, dan E. Aliran elektron yang benar adalah dari anoda ke katoda. Jawaban yang tepat adalah A dan E, kedua gambar indentik, sama persis.
Jawaban yang tepat A dan E.
Soal nomor 23:
Elektrolisis suatu larutan menghasilkan reaksi sebagai berikut:
Gambar yang tepat untuk peristiwa elektrolisis di atas adalah ....

Pembahasan soal nomor 23:
Reaksi reduksi di katoda adalah reduksi kation dari dalam larutan. Jadi larutan harus mengandung ion Ni2+.
Pilihan A dan D sudah pasti salah karena tidak terdapat Ni2+.
Reaksi oksidasi di anoda adalah oksidasi air bukan anion yang berasal dari larutan. Pilihan C menjadi tidak tepat lagi karena Cl– dapat teroksidasi, dan pilihan D juga tidak tepat karena Ni bukan elektroda inert sehingga ada kemungkinan ia yang mengalami oksidasi, nyatanya tidak terjadi.
Adanya anion sulfat yang tidak dapat mengalami oksidasi maka airlah yang mengalami oksidasi.
Jawaban yang tepat B
Soal nomor 24:
Pada percobaan pengujian titik beku larutan urea yang massanya sama dengan larutan NaCl, (11,7 g dalam 1 L larutan) ternyata menghasilkan titik beku yang berbeda. Tf larutan Urea = – 0,367oC, Tf larutan NaCl = - 0,744oC. Jika Mr CO(NH2)2 = 60 dan Mr NaCI = 58,5 serta deiajat ionisasi NaCl = 1, besarnya tetapan penurunan titik beku molal dari kedua percobaan adalah ….
Urea merupakan larutan nonelektrolit.
molalitas urea = (11,7 g : 60 g/mol) : 1 kg = 0,195 molal
∆Tb = molalitas urea × Kf
0,367 oC = 0,195 molal × Kf
Kf = 0,367 oC : 0,195 molal = 1,882 oC/molal
NaCl merupakan larutan elektrolit dengan i = 2.
molalitas NaCl = (11,7 g : 58,5 g/mol) : 1 kg = 0,20 molal
∆Tb = molalitas NaCl × Kf × i
0,744 oC = 0,20 molal × Kf × 2
Kf = 0,744 oC : 0,40 molal = 1,86 oC/molal
Jadi jawaban yang tepat D.
Soal nomor 25:
Data percobaan tentang titik beku 4 larutan pada suhu 27oC dan tekanan 1 atm tercantum pada tabel berikut.
Pada konsentrasi yang sama, larutan CO(NH2)2 dan NaCl memiliki titik beku yang berbeda.
Hal ini disebabkan kedua larutan ....
A. Mempunyai molekul yang tidak sama besarya
B. Mempunyai derajat ionisasi yang sama
C. Menghasilkan jumlah partikel yang tidak sama
D. Sama-sama larutan elektrolit
E. Sama-sama larutan non elektrolit
Pembahasan soal nomor 25:
Larutan urea adalah larutan nonelektrolit yang tidak dapat terionisasi.
Larutan NaCl merupakan larutan elektrolit yang dapat terionkan menjadi 2 partikel ion setiap 1 NaCl.
Keduanya menghasilkan jumlah partikel yang tidak sama maka keduanya memiliki titik beku berbeda pula.
Jawaban yang tepat B
Soal nomor 26:
Diketahui energi ikatan rata-rata:
H−H = 435 kJ/mol
N≡N = 946 kJ/mol
N−H = 390 kJ/mol
Kalor yang diperlukan untuk menguraikan 1,7 gram gas ammonia (Ar N = 14, dan H = 1) menjadi unsur-unsurnya adalah ....
Reaksi setara penguraian amonia:
2NH3→ N2 + 3H2
∆H untuk penguraian 2 mol NH3
2(3(N−H)) → N≡N + 3(H−H)
∆H = Total energi pemutusan ikatan di ruas kiri – Total energi pembentukan ikatan di ruas kanan
∆H = 2(3×390 kJ/mol) – (946 kJ/mol + 3(435 kJ/mol))
∆H = 2.340 kJ – 2.251 kJ
∆H = 89 kJ
→ ∆H permol = 89 kJ : 2 mol = 44,5 kJ/mol
Penguraian 1,7 gram NH3 :
Massa molar NH3 = 14 + 3(1) = 17 gram/mol
Jumlah mol NH3 = 1,7 gram : 17 gram/mol
Jumlah mol NH3 = 0,1 mol
Jadi ∆H untuk 0,1 mol NH3 = 44,5 kJ/mol × 0,1 mol
Jadi ∆H untuk 0,1 mol NH3 = 4,45 kJ
Jawaban yang tepat A
Soal nomor 27:
Bacalah wacana berikut!
Kunci yang terbuat dari besi akan disepuh dengan logam emas menggunakan kuat arus 10 ampere selama 9650 detik, seperti gambar berikut.
Pada reaksi penyepuhan kunci besi dengan logam emas diperlukan arus listrik 0,015 Faraday,
massa logam emas yang melapisi kunci besi tersebut adalah …. (Ar Au = 197)
Soal ini sebenarnya kelebihan data. Sayangnya data pertama (arus listrik dan waktu) memberikan hasil yang berbeda.
Au3+ + 3e–→ Ag
Massa ekivalen Au (e) = 197/3 = 65,67 g; t = 9650 detik; i = 10 ampere.
massa Au yang digunakan untuk melapisi kunci
m = (65,67 × 10 × 9.650)/96.500
m = 65,67 g → data tidak menghasilkan massa yang sama dengan data berikut.
massa Au yang digunakan untuk melapisi kunci
Massa ekivalen Au (e) = 197/3 = 65,67 g; F = 0,015 Faraday.
massa Au = e.F = 65,67 × 0,015 F = 0,985 g
Jawaban yang tepat C.
Soal nomor 28:
Perhatikan wacana berikut.
Senyawa aktif pada pemutih adalah senyawa natrium hipoklorit (NaClO). Untuk menghitung kadar NaClO dalam pemutih digunakan reaksi iodometri sebagai berikut.
NaClO(l) + 2KI(aq) + 2HCl(aq) → NaCl(aq) + 2KCl(aq) + I2(l) + H2O(l)
I2(l) + 2Na2S2O3(aq) → 2NaI(aq) + Na2S2O6(aq)
Berdasarkan wacana tersebut, untuk menghitung kadar NaClO dalam pemutih digunakan titrasi iodometri dengan Na2S2O3 sebagai larutan standar. Jika 20 mL NaClO dititrasi memerlukan 15 mL Na2S2O3 0,1 M, maka kadar NaClO (w/w) dalam pemutih tersebut adalah .... (Mr NaClO = 74,5, massa jenis NaClO = 1 g/mL).
Massa NaClO kotor:
Massa NaClO = Volume NaClO × massa jenis NaClO
Massa NaClO = 20 mL × 1 g/mL
Massa NaClO = 20 g
Hitungan dari titrasi:
Perbandingan koefisien antara NaClO dengan koefisien Na2S2O3 = 1 : 2.
Jumlah mol Na2S2O3 yang diperlukan = 15 mL × 0,1 M = 1,5 mmol
Jadi jumlah mol NaClO = ½ × 1,5 mmol = 0,75 mmol = 0,00075 mol
Massa NaClO = jumlah mol NaClO × massa molar NaClO
Massa NaClO = 0,00075 mol × 74,5 g/mol
Massa NaClO = 0,055875 g
Kadar NaClO = (massa NaClO titrasi : massa NaClO kotor) × 100%
Kadar NaClO = (0,055875 g : 20 g) × 100%
Kadar NaClO = 0,279%
Jawaban yang tepat A.
Soal nomor 29:
Diketahui data entalpi pembentukan standar sebagai berikut.
ΔHf CO2(g) : - 394 kJ/mol
ΔHf H2O(g) : - 286 kJ/mol
ΔHf C2H5OH(l) : - 266 kJ/mol
Entalpi pembakaran standar dari pembakaran etanol menurut persamaan reaksi:
C2H5OH(l) + 3O2(g) ® 2CO2(g) + 3H2O(l) adalah ....
Pembakaran standar adalah pembakaran 1 mol zat yang dilakukan pada keadaan standar.
∆Hco = S∆Hfo (produk) – S∆Hfo (pereaksi)
∆Hco C2H5OH = (2.∆Hfo CO2 + 3.∆Hfo H2O ) – ∆Hfo C2H5OH
∆Hco C2H5OH = (2(–394) + 3.(–286)) – (–266 kJ)
∆Hco C2H5OH = –1.646 kJ + 266 kJ
∆Hco C2H5OH = –1.380 kJ
Jawaban yang tepat B.
Soal nomor 30:
Bacalah wacana berikut!
Seorang siswa melakukan percobaan menyelidiki faktor-faktor penyebab korosi pada besi.
Bahan besi yang digunakan adalah paku yang telah diamplas. Diagram percobaan yang
dilakukan adalah sebagai berikut.
Keterangan:
Berdasarkan percobaan tersebut, faktor penyebab terjadinya korosi besi adalah ....
Jawaban E adanya oksigen dan uap air yang lembab menjadi penyebab terjadinya korosi. Cukup jelas.
Jawaban yang tepat E.
Soal nomor 31:
Berikut ini pasangan senyawa karbon.
Pasangan senyawa karbon yang benar adalah ....
(1) nama benar tetapi isomer dan jenisnya salah, bukan isomer melainkan indentik
(2) nama benar dan isomernya benar (jumlah dan jenis atom sama) dan jenisnya isomer posisi, beda letak ikatan rangkap.
(3) nama benar dan isomernya benar (jumlah dan jenis atom sama) dan jenisnya isomer fungsi. Golongan keton memang berisomer fungsi dengan golongan aldehid.
(4) nama benar dan bukan isomer yang tepat. Asam alkanoat/ asam karboksilat berisomer fungsi dengan alkil alkanoat, yang ada itu adalah jenis alkanol/alkohol.
Pilhan yang benar hanya (2) dan (3)
Soal nomor 32:
Perhatikan rumus struktur senyawa C3H6O berikut ini!
Perbedaan sifat kimia senyawa (1) dan senyawa (2) adalah ....
Pembahasan soal nomor 32:
(1) adalah propanal (golongan aldehid) dan (2) adalah propanon (golongan keton).
Aldehid dapat dioksidasi menjadi asam alkanoat/karboksilat sehingga dapat memerahkan lakmus biru yang menandai bahwa memang hasil oksidasinya bersidat asam. Keton sulit teroksidasi kecuali menggunakan oksidator yang sangat kuat.
Jawaban yang tepat D.
Soal nomor 33:
Terdapat 2 jenis monomer sebagai berikut.
Jika kedua monomer bereaksi akan membentuk polimer ....
Ini jenis soal hafalan. Nilon 6,6.
Jawaban yang tepat C.
Soal nomor 34:
Pembakaran sempurna gas etanol sebagai bahan bakar altematif mengikuti persamaan reaksi
berikut. C2H5OH(g) + O2(g) ® CO2(g) + H2O(l) (belum setara). Jika pada pembakaran
tersebut dibutuhkan 5,6 L gas oksigen dan etanol yang dibakar 1,12 L, massa air yang terbentuk diukur pada keadaan STP adalah …. (Mr H2O = 18)
Volume gas-gas dalam reaksi akan sebanding dengan koefisien reaksi gas dalam persamaan reaksi yang setara. Pada keadaan STP setiap 1 mol gas = 22,4 L
Reaksi setara: C2H5OH(g) + 3O2 (g) → 2CO2(g) + 3H2O(g)
Jumlah mol H2O = 3,36 L : 22,4 L/mol = 0,25 mol
massa H2O = 0,15 mol × 18 g/mol = 2,7 gram
Jawaban yang tepat B.
Soal nomor 35:
Untuk menentukan kadar gula dalam tubuh pasien digunakan pereaksi ….
Jawaban yang tepat A.
Soal nomor 36:
Bacalah wacana berikut.
Biodiesel merupakan salah satu bahan bakar terbarukan alternatif yang dibuat dari minyak
nabati/lemak hewani alami maupun inyak jelantah. Proses pembuatan biodiesel melibatkan reaksi transesterifikasi minyak/lemak dengan pereaksi alkohol dan basa kuat menghasilkan monoalkilester dan gliserin sebagai hasil samping.
Biodiesel memiliki karakteristik pembakaran yang mirip dengan solar dari minyak bumi, namun emisi pembakaran biodiesel lebih ramah lingkungan dibandingkan solar sehingga dapat digunakan sebagai bahan bakar tersendiri maupun dicampur dengan solar untuk mereduksi emisi gas beracun hasil pembakaran solar. Solar merupakan bahan bakar yang berasal dari pengolahan minyak bumi yang kandungannya teridi atas senyawa-senyawa
alkana rantai panjang C16-C20. Selain itu, solar mengandung senyawa nitrogen dan sulfur yang pada pembakarannya menghasilkan senyawa beracun. Campuran biodiesel dan solar di Indonesia disebut biosolar. Biodiesel dapat dicampur pada berbagai perbandingan dengan
solar. Campuran 5% biodiesel dan 95% solar diberi kode B5.
Pasangan berikut yang menunjukkan rumus struktur dari komponen utama biodiesel dan
petrolium diesel (solar), berturut-turut adalah ....
Pembahasan soal nomor 36:
Rumus kimia gliserin dan solar sebagai komponen biodiesel ada di pilihan B, cukup jelas.
Jawaban yang tepat B.
Soal nomor 37:
Data suatu unsur sebagai berikut.
A. Natrium
B. Magnesium
C. Aluminium
D. Silikon
E. Pospor
Pembahasan soal nomor 37:
Data itu menunjukkan sifat logam Mg. Cukup jelas.
Jawaban yang tepat B.
Soal nomor 38:
Bacalah wacana berikut.
Sabun dapat dibuat melalui proses batch atau kontinu. Pada proses batch, lemak atau minyak dipanaskan dengan alkali (NaOH atau KOH) berlebih dalam sebuah ketel. Jika penyabunan telah selesai, garam-garam ditambahkan untuk mengendapkan sabun. Lipisan air yang mengandung garam, gliserol dan kelebihan alkali dikeluarkan dan gliserol diperoleh lagi dari proses penyulingan seperti pada reaksi:
Di dalam sabun terdapat struktur bipolar, bagian kepala bersifat hidrofilik dan bagian
ekor bersifat hidrofobik
Prinsip kerja sabun saat digunakan adalah ....
Bagian ekor molekul sabun sifatnya tidak dapat menyatu dengan air tetapi akan menyatu dengan minyak/lemak. Bagian ekor molekul sabun bersifat nonpolar dan minyak juga nonpolar maka mereka saling melarutkan. Selanjutnya molekul minyak yang terikat dengan bagian ekor ini membentuk misel yang tidak mudah mengendap, terkurung oleh bagian kepala yang justru mudah mengikat air karena bagian kepala dan air ini sama-sama bersifat polar. Ketika dilakukan pembilasan minyak ikut mengalir bersama air, bersih.
Jawaban yang tepat E.
Soal nomor 39:
Perhatikan persamaan reaksi berikut.
Jenis reaksi pada I, II, dan III berturut-turut merupakan reaksi ....
A. Adisi, eliminasi, substitusi
B. Eliminasi, adisi, substitusi
C. Adisi, substitusi, eliminasi
D. Eliminasi, substitusi, adisi
E. Substitusi, adisi, eliminasi
Pembahasan soal nomor 39:
Reaksi I adalah reaksi adisi, mengubah ikatan rangkap pada C=O menjadi berikatan tunggal
Reaksi II adalah reaksi substitusi, terjadi pergantian gugus OH digantikan gugus Cl.
Reaksi III adalah reaksi eliminasi, terjadi pengubahan ikatan tunggal menjadi ikatan rangkap dan melepaskan gugus Cl dan H menjadi HCl.
Jadi jawaban yang tepat C.
Soal nomor 40:
Perhatikan data berikut! 1 – 3
Berdasarkan data tersebut, pasangan data yang berhubungan dengan benar adalah ....
Jawaban yang tepat D. 2 dan 4
Sumber : diunduh/copy dari www.urip.info dan dipulikasi ulang
Diketahui unsur 11X dapat bereaksi dengan unsur 17Y, sifat fisik senyawa yang terbentuk dan jenis ikatannya berturut-turut adalah ....
- Lelehannya dapat menghantarkan arus listrik, ikatan ionik
- Tidak larut dalam air, ikatan kovalen
- Tidak larut dalam air, ikatan ionik
- Larutannya penghantar listrik, ikatan kovalen
- Larutan tidak menghantar listrik, ikatan ionik
Konfigurasi elektron 11X = 2-8-1→ stabil X+
Konfigurasi elektron 17Y = 2-8-7 → stabil Y–
X+ + Y–→ XY (berikatan ionik, senyawa ion)
Sifat-sifat senyawa ion: larut dalam air, larutan dan lelehannya dapat menghantarkan arus listrik, titik lelehnya relatif tinggi.
Jawaban yang tepat A.
Soal nomor 2
Diketahui dua ion A2+ dan B- memiliki lintasan elektron sebagai berikut.
Jika unsur A mempunyai jumlah neutron 12 dan unsur B mempunyai jumlah neutron 18 pasangan data yang tepat adalah ....
Pembahasan soal nomor 2:
A2+ mempunyai 10 elektron,
A keadaan netral = 10 + 2 = 12 → Nomor atom A = 12
Konfigurasi elektron A = 2-8-2
→ golongan II-A, periode-3
Nomor massa A = jumlah netron A + nomor atom A
Nomor massa A = 12 + 12 = 24
A → golongan II-A, periode-3, 12A24
B– mempunyai 18 elektron
B keadaan netral = 18 – 1 = 17, → Nomor atom B = 17
Konfigurasi elektron B = 2-10-7
→ golongan VII-A, periode-3
Nomor massa B = jumlah netron L + nomor atom L
Nomor massa B = 18 + 17 = 35
B → golongan VII-A, periode-3, 17B35
Jawaban yang tepat D.
Soal nomor 3:
Perhatikan konfigurasi elektron unsur X dan Y berikut.
X: 1s2 2s22p6 3s23p3
Y: 1s2 2s22p6 3s23p5
Jika kedua unsur tersebut membentuk senyawa, rumus kimia dan bentuk molekul yang benar adalah
Pembahasan soal nomor 3:
X: elektron valensinya 5, X berada di periode 3, ada kemungkinan tidak mengikuti aturan oktet.
Y: elektron valensinya 7, perlu 1 elektron untuk stabil sesuai aturan oktet.
Kemungkinan pertama: A3 + B1 → AB3→ 3 pasangan elektron berikatan dan 1 pasangan elektron bebas, bentuk piramida segitiga, tidak tersedia pada opsi soal.
Kemungkinan kedua, A menggunakan 5 elektron valensinya: A5 + B1 → AB5→ 5 pasangan elektron berikatan dan tanpa pasangan elektron bebas, bentuk bipiramida segitiga, tersedia pada opsi soal.
Jawaban yang tepat D.
Soal nomor 4
Jika unsur 7A dan 17B berikatan, struktur Lewis yang benar adalah ....
Pembahasan soal nomor 4:
Yang digunakan untuk menentukan elektron valensi adalah nomor atom.
A nomor atom 7, konfigurasi elektron 2 – 5.
Elektron valensi A = 5, kurang 3 elektron untuk memenuhi aturan oktet.
B nomor atom 17, konfigurasi elektron 2 – 10 – 7.
Elektron valensi B = 7, kurang 1 elektron untuk memenuhi aturan oktet.
A3 + B1→ A1B3→ AB3→ A berikatan tunggal dengan 3B dan masih ada 1 pasang elektron bebas.
Jawaban yang tepat C.
Soal nomor 5:
Pada ruang tertutup dilakukan pembakaran 7 gram besi dengan 4 gram sulfur menghasilkan
besi sulfida sebanyak 11 gram. Kenyataan ini sesuai hukum dasar kimia, yaitu ....
A. Hukum Perbandingan Tetap (Proust)
B. Hukum Perbandingan Volume (Gay Lussac)
C. Hukum Kekekalan Massa (Lavoisier)
D. Hukum Perbandingan Berganda (Dalton)
E. Hukum Perbandingan Molekul (Avogadro)
Pembahasan soal nomor 5:
Yang kasatmata pada soal ini adalah total massa sebelum bereaksi (7 g + 4 g = 11 g) dan setelah bereaksi juga 11 g. Ini sesuai dengan hukum kekekalan massa (Hukum Lavoisier).
Jawaban yang tepat C.
Soal nomor 6:
Perhatikan data hasil uji daya hantar listrik terhadap beberapa larutan berikut!
Berdasarkan data tersebut, pasangan larutan yang memiliki derajat ionisasi = 0, ditunjukkan
pada nomor ....
- 1 dan 2
- 1 dan 3
- 2 dan 4
- 3 dan 5
- 4 dan 5
Derajat ionisasi nol hanya dimiliki larutan nonelektrolit karena tidak dapat terurai. Bila dalam uji daya hantar listrik maka lampu tidak akan menyala dan tidak ada gelembung pada elektroda.
Jawaban yang tepat A.
Soal nomor 7:
Perhatikan data titrasi asam-basa asam sulfat X M dengan NaOH 0,4 M berikut!
| V H2SO4 | V NaOH | |
| 1 | 20 mL | 24,0 mL |
| 2 | 20 mL | 23,8 mL |
| 3 | 20 mL | 24,2 mL |
- 0,32%
- 0,49%
- 0,98%
- 1,30%
- 4,90%
Massa H2SO4 kotor:
Massa H2SO4 = 20 mL × 1,8 g/mL = 36 g
Volume rata-rata NaOH = (24 + 23,8 + 24,2) mL : 3 = 24 mL
Jumlah mol NaOH = 24 mL × 0,4 M = 9,6 mmol.
Reaksi: 2NaOH + H2SO4→ Na2SO4 + 2H2O
Dari perbandingan koefisien reaksi setara dihitung jumlah mol H2SO4.
Jumlah mol H2SO4 = ½ jumlah mol NaOH
Jumlah mol H2SO4 = ½ × 9,6 mmol
Jumlah mol H2SO4 = 4,8 mmol = 0,0048 mol
Massa H2SO4 dari hasil titrasi:
Massa 0,0048 mol H2SO4 = 0,0048 mol × 98 g/mol
Massa 0,0048 mol H2SO4 = 0,4704 g
Kadar H2SO4 = (massa H2SO4 titrasi : massa H2SO4 kotor) × 100%
Kadar H2SO4 = (0,4704 g : 36 g) × 100%
Kadar H2SO4 = 1,30%
Jawaban yang tepat D.
Soal nomor 8:
Perhatikan gambar dua larutan berikut ini!
Pernyataan terkait kedua larutan tersebut, antara lain:
- Kedua larutan sama-sama memiliki pH = 3
- Kedua larutan adalah asam lemah
- Kedua larutan memiliki harga [H+] yang sama
- Kedua larutan dapat mengubah warna lakmus merah
- Kedua larutan dapat terionisasi sempurna
A. 1 dan 3
B. 1 dan 5
C. 2 dan 4
D. 2 dan 5
E. 3 dan 5
Pembahasan soal nomor 8:
pH HCl = -log(10–3) = 3
pH CH3COOH = -log(√(10–1.10–5) = -log(10–3) = 3
Jadi kedua larutan memiliki pH sama, [H+] juga sama.
HCl merupakan asam kuat (terurai sempurna) dan CH3COOH merupakan asam lemah (terurai sebagian), bila diuji dengan lakmus merah tidak akan berubah warna. Penjelasan yang benar (1), (3)
Jawaban yang tepat A.
Soal nomor 9:
Diketahui campuran larutan penyangga sebagai berikut.
Jika Ka CH3COOH = 10-5, maka urutan pH dimulai dari yang terkecil adalah ....
- 1 – 2 – 3
- 1 – 3 – 2
- 2 – 1 – 3
- 3 – 1 – 2
- 3 – 2 – 1
[H+] = Ka(mol asam lemah)/(mol basa konjugat)
(1) [H+] = 10–5.(5 mmol/5 mmol) = 10–5 M
(2) [H+] = 10–5.(5 mmol/10 mmol) = 5 ×10–6 M
(3) [H+] bukan campuran larutan penyangga, tidak CN– bukanlah basa konjugat dari CH3COOH.
pH berbanding terbalik dengan [H+], semakin besar [H+] maka pH semakin kecil.
Jadi urutan yang benar adalah (1), (2)
Jawaban yang tepat TIDAK TERSEDIA.
Soal nomor 10
Bacalah wacana berikut ini.
pH normal darah manusia adalah dirancang selalu relatif tetap, yaitu 7,4 ± 0,05. Komponen utama buffer darah adalah H2CO3 dan HCO3- dengan perbandingan 1:20, yang merupakan salah satu hasil metabolisme pernafasan.
CO2(g) ⇌ CO2(aq)
CO2(aq) + H2O(l) ⇌H2CO3(aq)
H2CO3(aq) + H2O(l) ⇌ H3O+(aq) + HCO3-
Pada kasus alkalosis atau kelebihan basa yang disebabkan kekurangan CO2 terlarut, pH darah naik hingga mencapai 7,8. Jika dibiarkan akan menyebabkan kerusakan sistem syaraf. Salah satu upaya mengembalikan pH normal darah adalah dengan pemberian masker gas oksigen didukung infus larutan buffer bikarbonat pH 6,7 selama selang waktu tertentu. (Ka H2CO3 = 4,3 x 10-7).
Berdasarkan wacana tersebut, pemberian larutan bikarbonat pH 6,7 bertujuan untuk ….
- Menaikkan pH darah dengan menggeser kesetimbangan ke arah kiri
- Menaikkan pH darah dengan menggeser kesetimbangan ke arah kanan
- Menaikan pH darah tanpa menggeser arah kesetimbangan
- Menurunkan pH darah dengan menggeser kesetimbangan ke arah kiri
- Menurunkan pH darah dengan menggeser kesetimbangan ke arah kanan
Kasusnya adalah alkolisis atau kelebihan basa dengan pH di atas 7,4. Tujuan utamanya adalah menurunkan pH darah agar normal. Menambah NaHCO3 (atau HCO3–) dengan pH 6,7 berarti meningkatkan konsentrasi H2CO3 yang berada di ruas kiri. Bila menambah konsentrasi zat di ruas kiri maka kesetimbangan akan bergeser ke kanan, terbentuk lebih banyak H3O+ hingga pH normal kembali.
Jawaban yang tepat E.
Soal nomor 11:
Perhatikan tabel persamaan reaksi hidrolisis garam berikut ini!
Pasangan data garam terhidrolisis yang tepat adalah ....
- 1 dan 2
- 1 dan 3
- 1 dan 4
- 2 dan 3
- 2 dan 4
Pasangan data untuk garam hidrolisis yang tepat adalah (1) dan (3)
Hidrolisis basa konjugat dari asam lemah akan menghasilkan [OH–] sehingga sifat larutan akan basa dan pH > 7.
Hidrolisis asam konjugat dari basa lemah akan menghasilkan [H3O+] sehingga sifat larutan akan asam dan pH < 7.
Jawaban yang tepat B.
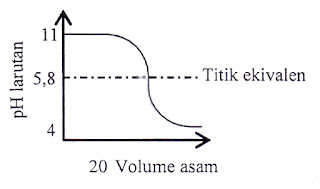
Soal nomor 12:
Diketahui data beberapa indikator dan trayek pH.
Berikut ini adalah kurva titrasi asam-basa.
Pasangan asam-basa/basa-asam dan indikator yang digunakan adalah ....
- KOH – CH3COOH, fenolptalein
- KOH – HCl, fenolptalein
- CH3NH3 – HCl, metil jingga
- NH4OH – CH3COOH, metil jingga
- NaOH – HCl, fenolptalein
Prinsip umum untuk titrasi:
Titrasi asam kuat ke basa kuat titik ekivalennya sama dengan 7.
Titrasi asam kuat ke basa lemah titik ekivalennya biasa di bawah 7
Titrasi basa kuat ke asam lemah titik ekivalennya biasa di atas 7
A-B-E jelas tidak tepat.
Pilihan D sepertinya juga tidak mungkin benar sebab pH basa lemah biasa tidak jauh di atas 7.
Pada soal ini skala pH tidak proporsional, ini dapat dilihat jarak pH 4 ke 5,8 dibanding 5,8 ke pH 11. Kalau pun mau memilih C agak mendekati kebenaran walau berdasar rentang pH indikator menjadi keliru juga.
Jawaban yang tepat TIDAK ADA JAWABAN YANG TEPAT.
Soal nomor 13:
Diketahui Ksp Mg(OH)2 = 6 × 10-12. Dua buah larutan dicampur dengan komposisi sebagai berikut.
Pasangan campuran yang menghasilkan endapan Mg(OH)2 ditunjukkan pada nomor ....
- 1 dan 4 karena Qsp < Ksp
- 1 dan 5 karena Qsp > Ksp
- 2 dan 3 karena Qsp < Ksp
- 2 dan 4 karena Qsp < Ksp
- 3 dan 5 karena Qsp < Ksp
Syarat terbentuknya endapan nilai Qc > Ksp
Qsp Mg(OH)2 = [Mg2+][OH–]2
(1) → 10–3 × (10–5)2 = 10–3 × 10–10 = 10–13
(2) → 10–4 × (10–3)2 = 10–4 × 10–6 = 10–10
(3) → 10–5 × (10–4)2 = 10–5 × 10–8 = 10–13
(4) → 10–3 × (10–3)2 = 10–3 × 10–6 = 10–9
(5) → 10–5 × (10–5)2 = 10–5 × 10–10 = 10–15
Qc Mg(OH)2 yang nilainya lebih besar dari 6×10–12 (Ksp Mg(OH)2) adalah (2) dan (4)
Jawaban yang tepat TIDAK TERSEDIA (semestinya D tetapi harus Qc > Ksp)
Soal nomor 14:
Jika kita memasukkan bongkahan batu kapur ke dalam air, akan terjadi gelembung-gelembung gas dan wadah akan terasa panas.
Pernyataan yang benar dari data percobaan tersebut adalah ….
- Reaksi tersebut merupakan reaksi eksoterm karena sistem menyerap kalor dari
- Reaksi tersebut merupakan reaksi endoterm karena lingkungan menyerap kalor
dari sistem. - Reaksi tersebut merupakan reaksi eksoterm karena sistem melepas kalor ke lingkungan.
- Reaksi tersebut merupakan reaksi endoterm karena lingkungan menerima kalor dari sistem.
- Reaksi tersebut merupakan reaksi eksoterm karena lingkungan melepas kalor ke sistem.
Ketika wadah panas tentu dari reaksi batu kapur dalam air (sebagai sistem) yang memang melepaskan panas/kalor. Terjadi perpindahan panas dari sistem ke lingkungan.
Jawaban yang tepat C.
Soal nomor 15:
Diketahui data percobaan reaksi 2A + B2 → 2AB
Grafik yang menunjukkan orde reaksi dari A adalah ....
Pembahasan soal nomor 15:
Penentuan orde reaksi terhadap A.
Pilih data 2 dan 1, untuk menentukan orde reaksi dari A, karena konsentrasi B tetap (sama)
([A2]/[A1])n = v2/v1
(2a/a)n = 64/16
2n = 4
2n = 22
n = 2
Karena orde terhadap A adalah 2 maka grafik yang sesuai adalah grafik pada pilihan C
Jawaban yang tepat C.
Soal nomor 16:
Ke dalam 4 gelas kimia yang masing-masing berisi 20 mL asam sulfat dimasukkan 4 gram
logam seng seperti pada gambar berikut!
Kondisi yang diharapkan:
- Variabel bebas: luas permukaan sentuh
- Variabel terikat: laju/waktu
- Variabel terkontrol: [H2SO4]
Pasangan gambar yang sesuai dengan kondisi tersebut adalah ....
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan soal nomor 16:
Bila variabel bebasnya adalah luas permukaan sentuh, maka variabel luas permukaan harus dibuat beda.
Bila variabel terikatnya adalah waktu/laju, besarnya waktu akan ditentukan berdasar luas permukaan sentuh yang dibuat berbeda.
Bila variabel kontrolnya [H2SO4], maka konsentrasi pasangan harus tetap agar dapat digunakan melihat efek perubahan luas permukaan sentuh yang merupakan variabel bebas.
Di antara gambar yang luas permukaan sentuhnya berbeda hanyalah (2), artinya gambar (2) ini akan berpasangan dengan gambar lain. Bila tidak ada nomor (2) pada pasangan sudah pasti salah.
Bila dipasangkan (1) dan (2). Variabel lain semua tetap/sama, hanya luar permukaan sentuh yang berbeda, ini pilihan tepat.
Bila dipasangkan (2) dan (3) maka variabel bebasnya ada dua, yaitu luas permukaan sentuh dan konsentrasi H2SO4, ini jadi tidak tepat.
Bila dipasangkan (2) dan (4) maka variabel bebasnya ada dua, yaitu luas permukaan dan suhu, ini jadi tidak tepat.
Jawaban yang tepat A.
Soal nomor 17:
Bacalah informasi berikut!
Di negara yang memiliki musim dingin, proses pencairan es yang terdapat di jalan-jalan dan
trotoar dilakukan dengan menaburkan garam ke hamparan salju.
Sifat koligatif larutan yang paling tepat berhubungan dengan fenomena wacana di atas adalah ....
A. Penurunan tekanan uap
B. Kenaikkan titik didih
C. Penurunan titik beku
D. Tekanan osmosis
E. Kenaikkan tekanan uap
Pembahasan soal nomor 17:
Penentuan orde reaksi terhadap A.
Salju (air beku) diberi garam agar pada suhu rendah salju dapat mencair, tidak beku. Dengan diberi garam yang relatif mudah larut maka terjadi penurunan titik beku air, sehingga ketika suhu nol derajat ia tidak beku.
Jawaban yang tepat C.
Soal nomor 18:
Proses pembuatan gas NO2 sesuai dengan reaksi:
2NO(g) + O2(g) ⇌ 2NO2(g)
Diperoleh data sebagai berikut:
| ToC | Kp |
| 600 | 18 |
| 1000 | 2 |
mengenai hal tersebut adalah ….
- Reaksi pembentukan gas NO2 adalah reaksi eksotermal, sehingga kenaikan suhu menyebabkan konsentrasi NO2
- Reaksi pembentukan gas NO2 adalah reaksi endotermal sehingga penurunan suhu akan mengubah komposisi zatnya dalam kesetimbangan
- Saat suhu dinaikkan tekanan parsial gas NO2 bertambah, tekanan parsial gas NO dan O2
- Saat suhu diturunkan tekanan parsial gas NO2 berkurang, tekanan dan O2
- Saat suhu diturunkan pada tekanan tetap, tekanan parsial gas NO3 = gas NH3
Dari tabel diketahui nilai Kp yang semakin kecil berarti tekanan parsial produk (NO2) berkurang dan tekanan parsial pereaksi (NO dan O2) bertambah ketika suhu dinaikkan dari 600 oC ke 1000 oC. Tekanan parsial berkurang sebanding dengan berkurangnya jumlah atau konsentrasi produk. Terjadi pergeseran dari kanan ke kiri, ketika suhu dinaikkan. Ini merupakan ciri reaksi eksoterm ke arah produk, jika suhu dinaikkan maka reaksi akan bergeser ke arah pereaksi (di kiri).
Pada reaksi eksoterm jika suhu diturunkan maka konsentrasi produk akan meningkat (kesetimbangan bergeser ke kanan) yang berati tekanan parsialnya juga bertambah dan konsentrasi pereaksi berkurang atau tekanan parsial pereaksi berkurang.
Jawaban yang tepat TIDAK TERSEDIA.
Soal nomor 19:
Bacalah informasi berikut!
Apabila seseorang memerlukan injeksi cairan nutrisi/infus, cairan infus tersebut harus bersifat isotonik dengan cairan dalam darah. Injeksi cairan,nutrisi/infus (NaCl, Mr NaCl = 58,5) harus isotonik dengan cairan dalam darah, berkisar 9,84 atm pada suhu ruangan 27oC. Apabila seseorang memerlukan 1 liter cairan infus, massa NaCl yang dibutuhkan adalah …. (R = 0,082 L.atm/mol.K)
- 4,68 gram
- 5,85 gram
- 11,7 gram
- 23,4 gram
- 46,8 gram
Tekanan osmotik larutan NaCl = tekanan cairan dalam darah.
Tekanan osmotik larutan NaCl = 9,84 atm.
9,84 atm = [NaCl] × R × T
9,84 atm = [NaCl] × 0,082 L.atm/(mol.K) × (27 + 273) K
9,84 atm = [NaCl] × 24,6 L.atm/mol
[NaCl] = 9,84 atm : 24,6 L.atm/mol
[NaCl] = 0,4 mol/L
Untuk setiap 1 L larutan = 0,4 mol NaCl
Massa NaCl = 0,4 mol × 58,5 g/mol
Massa NaCl = 23,4 g
Jawaban yang tepat D.
Soal nomor 20:
Perhatikan wacana berikut ini.
Senyawa aktif pada pemutih adalah senyawa natrium hipoklorit (NaClO). Untuk menghitung kadar NaClO dalam pemutih digunakan reaksi iodometri sebagai berikut.
NaClO(l) + KI(l) + 2HCl(aq) → NaCl(aq) + 2KCl(aq) + I2(l) + H2O(l)
I2(l) + 2Na2S2O3(aq) → 2NaI(aq) + Na2S2O6(aq)
Berdasarkan wacana tersebut, sifat kimia senyawa yang terdapat di dalam pemutih adalah ....
- Katalisator
- Reduktor
- Emulgator
- Oksidator
- Inhibitor
Fokus hanya pada zat pemutih. Pemutih (NaClO) pada reaksi pertama mengalami reaksi reduksi. Tepatnya bilangan oksidasi Cl pada NaClO berubah dari +1 menjadi –1 pada Cl– (dalam NaCl atau KCl). Karena ia mengalami reaksi reduksi maka ia berperan sebagai oksidator.
Jawaban yang tepat D.
Soal nomor 21:
Perhatikan wacana berikut ini.
Sendok logam yang terbuat dari zink akan disepuh dengan logam tembaga seperti gambar berikut.
Reaksi yang terjadi di katoda adalah ....
- Cu2+(aq) + Zn(s) → Cu(s) + Zn2+(aq)
- Zn(s) → Zn2+(aq) + 2e
- Zn2+(aq) + 2e → Zn(s)
- Cu(s) → Cu2+(aq) + 2e
- Cu2+(aq) + 2e → Cu(s)
Di katode akan terjadi reduksi kation. Kation dalam larutan adalah Cu2+.
Jadi reaksi di katoda: Cu2+(aq) + 2e–→ Cu(s)
Jawaban yang tepat A.
Soal nomor 22:
Diketahui notase sel Volta: Mg|Mg2+||Sn2+|Sn Eo = 2,23 V. Gambar sel Volta yang benar adalah ....
Pembahasan soal nomor 22:
Mg(s) | Mg2+aq) || Sn2+ (aq) | Sn(s) E0 = +2,23 Volt
Makna dari notasi sel:
Mg berperan sebagai anoda, Mg akan melarut atau teroksidasi menjadi Mg2+ dan Sn berperan sebagai katoda, di sini akan terjadi reduksi S2+ menjadi Sn.
Gambar yang sesuai dengan notasi sel adalah A, B, dan E. Aliran elektron yang benar adalah dari anoda ke katoda. Jawaban yang tepat adalah A dan E, kedua gambar indentik, sama persis.
Jawaban yang tepat A dan E.
Soal nomor 23:
Elektrolisis suatu larutan menghasilkan reaksi sebagai berikut:
Gambar yang tepat untuk peristiwa elektrolisis di atas adalah ....

Pembahasan soal nomor 23:
Reaksi reduksi di katoda adalah reduksi kation dari dalam larutan. Jadi larutan harus mengandung ion Ni2+.
Pilihan A dan D sudah pasti salah karena tidak terdapat Ni2+.
Reaksi oksidasi di anoda adalah oksidasi air bukan anion yang berasal dari larutan. Pilihan C menjadi tidak tepat lagi karena Cl– dapat teroksidasi, dan pilihan D juga tidak tepat karena Ni bukan elektroda inert sehingga ada kemungkinan ia yang mengalami oksidasi, nyatanya tidak terjadi.
Adanya anion sulfat yang tidak dapat mengalami oksidasi maka airlah yang mengalami oksidasi.
Jawaban yang tepat B
Soal nomor 24:
Pada percobaan pengujian titik beku larutan urea yang massanya sama dengan larutan NaCl, (11,7 g dalam 1 L larutan) ternyata menghasilkan titik beku yang berbeda. Tf larutan Urea = – 0,367oC, Tf larutan NaCl = - 0,744oC. Jika Mr CO(NH2)2 = 60 dan Mr NaCI = 58,5 serta deiajat ionisasi NaCl = 1, besarnya tetapan penurunan titik beku molal dari kedua percobaan adalah ….
- 0,031oC/m
- 0,520oC/m
- 0,604oC/m
- 1,860oC/m
- 3,720oC/m
Urea merupakan larutan nonelektrolit.
molalitas urea = (11,7 g : 60 g/mol) : 1 kg = 0,195 molal
∆Tb = molalitas urea × Kf
0,367 oC = 0,195 molal × Kf
Kf = 0,367 oC : 0,195 molal = 1,882 oC/molal
NaCl merupakan larutan elektrolit dengan i = 2.
molalitas NaCl = (11,7 g : 58,5 g/mol) : 1 kg = 0,20 molal
∆Tb = molalitas NaCl × Kf × i
0,744 oC = 0,20 molal × Kf × 2
Kf = 0,744 oC : 0,40 molal = 1,86 oC/molal
Jadi jawaban yang tepat D.
Soal nomor 25:
Data percobaan tentang titik beku 4 larutan pada suhu 27oC dan tekanan 1 atm tercantum pada tabel berikut.
| No | Zat terlarut | Larutan | |
| Molalitas | Titik beku | ||
| 1 | CO(NH2)2 | 1 | -2oC |
| 2 | CO(NH2)2 | 2 | -4oC |
| 3 | NaCl | 1 | -4oC |
| 4 | NaCl | 2 | -8oC |
Hal ini disebabkan kedua larutan ....
A. Mempunyai molekul yang tidak sama besarya
B. Mempunyai derajat ionisasi yang sama
C. Menghasilkan jumlah partikel yang tidak sama
D. Sama-sama larutan elektrolit
E. Sama-sama larutan non elektrolit
Pembahasan soal nomor 25:
Larutan urea adalah larutan nonelektrolit yang tidak dapat terionisasi.
Larutan NaCl merupakan larutan elektrolit yang dapat terionkan menjadi 2 partikel ion setiap 1 NaCl.
Keduanya menghasilkan jumlah partikel yang tidak sama maka keduanya memiliki titik beku berbeda pula.
Jawaban yang tepat B
Soal nomor 26:
Diketahui energi ikatan rata-rata:
H−H = 435 kJ/mol
N≡N = 946 kJ/mol
N−H = 390 kJ/mol
Kalor yang diperlukan untuk menguraikan 1,7 gram gas ammonia (Ar N = 14, dan H = 1) menjadi unsur-unsurnya adalah ....
- 4,45 kJ
- 8,90 kJ
- 108,1 kJ
- 1081 kJ
- 1170 kJ
Reaksi setara penguraian amonia:
2NH3→ N2 + 3H2
∆H untuk penguraian 2 mol NH3
2(3(N−H)) → N≡N + 3(H−H)
∆H = Total energi pemutusan ikatan di ruas kiri – Total energi pembentukan ikatan di ruas kanan
∆H = 2(3×390 kJ/mol) – (946 kJ/mol + 3(435 kJ/mol))
∆H = 2.340 kJ – 2.251 kJ
∆H = 89 kJ
→ ∆H permol = 89 kJ : 2 mol = 44,5 kJ/mol
Penguraian 1,7 gram NH3 :
Massa molar NH3 = 14 + 3(1) = 17 gram/mol
Jumlah mol NH3 = 1,7 gram : 17 gram/mol
Jumlah mol NH3 = 0,1 mol
Jadi ∆H untuk 0,1 mol NH3 = 44,5 kJ/mol × 0,1 mol
Jadi ∆H untuk 0,1 mol NH3 = 4,45 kJ
Jawaban yang tepat A
Soal nomor 27:
Bacalah wacana berikut!
Kunci yang terbuat dari besi akan disepuh dengan logam emas menggunakan kuat arus 10 ampere selama 9650 detik, seperti gambar berikut.
Pada reaksi penyepuhan kunci besi dengan logam emas diperlukan arus listrik 0,015 Faraday,
massa logam emas yang melapisi kunci besi tersebut adalah …. (Ar Au = 197)
- 0,0985 gram
- 0,2985 gram
- 0,9850 gram
- 2,9850 gram
- 9,8600 gram
Soal ini sebenarnya kelebihan data. Sayangnya data pertama (arus listrik dan waktu) memberikan hasil yang berbeda.
Au3+ + 3e–→ Ag
Massa ekivalen Au (e) = 197/3 = 65,67 g; t = 9650 detik; i = 10 ampere.
massa Au yang digunakan untuk melapisi kunci
m = (65,67 × 10 × 9.650)/96.500
m = 65,67 g → data tidak menghasilkan massa yang sama dengan data berikut.
massa Au yang digunakan untuk melapisi kunci
Massa ekivalen Au (e) = 197/3 = 65,67 g; F = 0,015 Faraday.
massa Au = e.F = 65,67 × 0,015 F = 0,985 g
Jawaban yang tepat C.
Soal nomor 28:
Perhatikan wacana berikut.
Senyawa aktif pada pemutih adalah senyawa natrium hipoklorit (NaClO). Untuk menghitung kadar NaClO dalam pemutih digunakan reaksi iodometri sebagai berikut.
NaClO(l) + 2KI(aq) + 2HCl(aq) → NaCl(aq) + 2KCl(aq) + I2(l) + H2O(l)
I2(l) + 2Na2S2O3(aq) → 2NaI(aq) + Na2S2O6(aq)
Berdasarkan wacana tersebut, untuk menghitung kadar NaClO dalam pemutih digunakan titrasi iodometri dengan Na2S2O3 sebagai larutan standar. Jika 20 mL NaClO dititrasi memerlukan 15 mL Na2S2O3 0,1 M, maka kadar NaClO (w/w) dalam pemutih tersebut adalah .... (Mr NaClO = 74,5, massa jenis NaClO = 1 g/mL).
- 0,279%
- 0,558%
- 1,116%
- 2,232%
- 4,464%
Massa NaClO kotor:
Massa NaClO = Volume NaClO × massa jenis NaClO
Massa NaClO = 20 mL × 1 g/mL
Massa NaClO = 20 g
Hitungan dari titrasi:
Perbandingan koefisien antara NaClO dengan koefisien Na2S2O3 = 1 : 2.
Jumlah mol Na2S2O3 yang diperlukan = 15 mL × 0,1 M = 1,5 mmol
Jadi jumlah mol NaClO = ½ × 1,5 mmol = 0,75 mmol = 0,00075 mol
Massa NaClO = jumlah mol NaClO × massa molar NaClO
Massa NaClO = 0,00075 mol × 74,5 g/mol
Massa NaClO = 0,055875 g
Kadar NaClO = (massa NaClO titrasi : massa NaClO kotor) × 100%
Kadar NaClO = (0,055875 g : 20 g) × 100%
Kadar NaClO = 0,279%
Jawaban yang tepat A.
Soal nomor 29:
Diketahui data entalpi pembentukan standar sebagai berikut.
ΔHf CO2(g) : - 394 kJ/mol
ΔHf H2O(g) : - 286 kJ/mol
ΔHf C2H5OH(l) : - 266 kJ/mol
Entalpi pembakaran standar dari pembakaran etanol menurut persamaan reaksi:
C2H5OH(l) + 3O2(g) ® 2CO2(g) + 3H2O(l) adalah ....
- – 1094 kJ/mol
- – 1380 kJ/mol
- – 1488 kJ/mol
- – 2986 kJ/mol
- – 2020 kJ/mol
Pembakaran standar adalah pembakaran 1 mol zat yang dilakukan pada keadaan standar.
∆Hco = S∆Hfo (produk) – S∆Hfo (pereaksi)
∆Hco C2H5OH = (2.∆Hfo CO2 + 3.∆Hfo H2O ) – ∆Hfo C2H5OH
∆Hco C2H5OH = (2(–394) + 3.(–286)) – (–266 kJ)
∆Hco C2H5OH = –1.646 kJ + 266 kJ
∆Hco C2H5OH = –1.380 kJ
Jawaban yang tepat B.
Soal nomor 30:
Bacalah wacana berikut!
Seorang siswa melakukan percobaan menyelidiki faktor-faktor penyebab korosi pada besi.
Bahan besi yang digunakan adalah paku yang telah diamplas. Diagram percobaan yang
dilakukan adalah sebagai berikut.
Keterangan:
- Indikator fenolptalein membentuk wama merah muda jika terdapat ion OH-.
- CaCl2 anhidrat merupakan zat yang higroskopis (menyerap air), sehingga udara dalam tabung bebas uap air.
- Air yang sudah dididihkan kehilangan oksigen terlarut
- K3Fe(CN)6 membentuk kompleks warna biru jika terdapat ion Fe2+
Berdasarkan percobaan tersebut, faktor penyebab terjadinya korosi besi adalah ....
- Besi memiliki kemampuan mengalami reduksi > Zn
- Adanya ion OH- (suasana basa) di sekitar besi
- Eo reduksi besi < reduksi air
- Besi merupakan oksidator kuat
- Adanya gas oksigen dan uap air di sekitar besi
Jawaban E adanya oksigen dan uap air yang lembab menjadi penyebab terjadinya korosi. Cukup jelas.
Jawaban yang tepat E.
Soal nomor 31:
Berikut ini pasangan senyawa karbon.
Pasangan senyawa karbon yang benar adalah ....
- 1 dan 2
- 1 dan 3
- 2 dan 3
- 2 dan 4
- 3 dan 4
(1) nama benar tetapi isomer dan jenisnya salah, bukan isomer melainkan indentik
(2) nama benar dan isomernya benar (jumlah dan jenis atom sama) dan jenisnya isomer posisi, beda letak ikatan rangkap.
(3) nama benar dan isomernya benar (jumlah dan jenis atom sama) dan jenisnya isomer fungsi. Golongan keton memang berisomer fungsi dengan golongan aldehid.
(4) nama benar dan bukan isomer yang tepat. Asam alkanoat/ asam karboksilat berisomer fungsi dengan alkil alkanoat, yang ada itu adalah jenis alkanol/alkohol.
Pilhan yang benar hanya (2) dan (3)
Soal nomor 32:
Perhatikan rumus struktur senyawa C3H6O berikut ini!
Perbedaan sifat kimia senyawa (1) dan senyawa (2) adalah ....
| Senyawa (1) | Senyawa (2) | |
| A | Dapat direduksi menjadi senyawa yang bereaksi dengan Na | Dapat direduksi menjadi senyawa yang tidak bereaksi dengan Na |
| B | Dapat dioksidasi menjadi alkohol primer | Dapat dioksidasi menjadi alkohol sekunder |
| C | Dapat diidentifikasi dengan pereaksi Tollens menghasilkan cermin perak | Tidak dapat beraksi dengan pereaksi Tollens |
| D | Dapat dioksidasi menghasilkan senyawa yang dapat memerahkan lakmus biru | Tidak dapat dioksidasi menjadi senyawa organik lain |
| E | Dapat bereaksi dengan logam Na | Tidak dapat bereaksi dengan logam Na |
Pembahasan soal nomor 32:
(1) adalah propanal (golongan aldehid) dan (2) adalah propanon (golongan keton).
Aldehid dapat dioksidasi menjadi asam alkanoat/karboksilat sehingga dapat memerahkan lakmus biru yang menandai bahwa memang hasil oksidasinya bersidat asam. Keton sulit teroksidasi kecuali menggunakan oksidator yang sangat kuat.
Jawaban yang tepat D.
Soal nomor 33:
Terdapat 2 jenis monomer sebagai berikut.
Jika kedua monomer bereaksi akan membentuk polimer ....
- Bakelit
- Dakron
- Nilon 6,6
- Perspek
- Polistirena
Ini jenis soal hafalan. Nilon 6,6.
Jawaban yang tepat C.
Soal nomor 34:
Pembakaran sempurna gas etanol sebagai bahan bakar altematif mengikuti persamaan reaksi
berikut. C2H5OH(g) + O2(g) ® CO2(g) + H2O(l) (belum setara). Jika pada pembakaran
tersebut dibutuhkan 5,6 L gas oksigen dan etanol yang dibakar 1,12 L, massa air yang terbentuk diukur pada keadaan STP adalah …. (Mr H2O = 18)
- 1,8 gram
- 2,7 gram
- 9,0 gram
- 18 gram
- 27 gram
Volume gas-gas dalam reaksi akan sebanding dengan koefisien reaksi gas dalam persamaan reaksi yang setara. Pada keadaan STP setiap 1 mol gas = 22,4 L
Reaksi setara: C2H5OH(g) + 3O2 (g) → 2CO2(g) + 3H2O(g)
| C2H5OH | + | 3O2 | → | 2CO2 | + | 3H2O | |
| Awal | 1,12 L | 5,6 L | - | - | |||
| Bereaksi | -1,12 L | -3,36 L | 2,24 L | 3,36 L | |||
| Sisa | habis | 2,24 L | 2,24 L | 3,36 L |
massa H2O = 0,15 mol × 18 g/mol = 2,7 gram
Jawaban yang tepat B.
Soal nomor 35:
Untuk menentukan kadar gula dalam tubuh pasien digunakan pereaksi ….
- Fehling, karena-pereaksi ini lebih spesifik untuk mengidentifikasi gugus aldehid
- Molish, karena pereaksi ini dapat mengidentifikasi zat golongan karbohidrat
- Millon, karena pereaksi ini dapat menentukan adanya fenol dalam protein
- Ninhidrin, karena pereaksi ini dapat mendeteksi asam amino
- Seliwanof, karena pereaksi ini dapat membedakan gula aldosa dan ketosa
Jawaban yang tepat A.
Soal nomor 36:
Bacalah wacana berikut.
Biodiesel merupakan salah satu bahan bakar terbarukan alternatif yang dibuat dari minyak
nabati/lemak hewani alami maupun inyak jelantah. Proses pembuatan biodiesel melibatkan reaksi transesterifikasi minyak/lemak dengan pereaksi alkohol dan basa kuat menghasilkan monoalkilester dan gliserin sebagai hasil samping.
Biodiesel memiliki karakteristik pembakaran yang mirip dengan solar dari minyak bumi, namun emisi pembakaran biodiesel lebih ramah lingkungan dibandingkan solar sehingga dapat digunakan sebagai bahan bakar tersendiri maupun dicampur dengan solar untuk mereduksi emisi gas beracun hasil pembakaran solar. Solar merupakan bahan bakar yang berasal dari pengolahan minyak bumi yang kandungannya teridi atas senyawa-senyawa
alkana rantai panjang C16-C20. Selain itu, solar mengandung senyawa nitrogen dan sulfur yang pada pembakarannya menghasilkan senyawa beracun. Campuran biodiesel dan solar di Indonesia disebut biosolar. Biodiesel dapat dicampur pada berbagai perbandingan dengan
solar. Campuran 5% biodiesel dan 95% solar diberi kode B5.
Pasangan berikut yang menunjukkan rumus struktur dari komponen utama biodiesel dan
petrolium diesel (solar), berturut-turut adalah ....
Pembahasan soal nomor 36:
Rumus kimia gliserin dan solar sebagai komponen biodiesel ada di pilihan B, cukup jelas.
Jawaban yang tepat B.
Soal nomor 37:
Data suatu unsur sebagai berikut.
- Hidroksidanya bersifat basa lemah
- Dapat bereaksi dengan air panas
- Merupakan reduktor kuat
- Senyawanya digunakan sebagai obat maag
A. Natrium
B. Magnesium
C. Aluminium
D. Silikon
E. Pospor
Pembahasan soal nomor 37:
Data itu menunjukkan sifat logam Mg. Cukup jelas.
Jawaban yang tepat B.
Soal nomor 38:
Bacalah wacana berikut.
Sabun dapat dibuat melalui proses batch atau kontinu. Pada proses batch, lemak atau minyak dipanaskan dengan alkali (NaOH atau KOH) berlebih dalam sebuah ketel. Jika penyabunan telah selesai, garam-garam ditambahkan untuk mengendapkan sabun. Lipisan air yang mengandung garam, gliserol dan kelebihan alkali dikeluarkan dan gliserol diperoleh lagi dari proses penyulingan seperti pada reaksi:
Di dalam sabun terdapat struktur bipolar, bagian kepala bersifat hidrofilik dan bagian
ekor bersifat hidrofobik
Prinsip kerja sabun saat digunakan adalah ....
- Mengendapkan kotoran
- Menaikkan tegangan permukaan air hingga bagian ekor akan mudah mengikat air
- Bagian kepala dari sabun mengikat air dan tersuspensi dalam air membentuk misel
yang tidak mudah mengendap - Menetralkan muatan kotoran
- Bagian ekor menarik air hingga kotoran mudah lepas
Bagian ekor molekul sabun sifatnya tidak dapat menyatu dengan air tetapi akan menyatu dengan minyak/lemak. Bagian ekor molekul sabun bersifat nonpolar dan minyak juga nonpolar maka mereka saling melarutkan. Selanjutnya molekul minyak yang terikat dengan bagian ekor ini membentuk misel yang tidak mudah mengendap, terkurung oleh bagian kepala yang justru mudah mengikat air karena bagian kepala dan air ini sama-sama bersifat polar. Ketika dilakukan pembilasan minyak ikut mengalir bersama air, bersih.
Jawaban yang tepat E.
Soal nomor 39:
Perhatikan persamaan reaksi berikut.
Jenis reaksi pada I, II, dan III berturut-turut merupakan reaksi ....
A. Adisi, eliminasi, substitusi
B. Eliminasi, adisi, substitusi
C. Adisi, substitusi, eliminasi
D. Eliminasi, substitusi, adisi
E. Substitusi, adisi, eliminasi
Pembahasan soal nomor 39:
Reaksi I adalah reaksi adisi, mengubah ikatan rangkap pada C=O menjadi berikatan tunggal
Reaksi II adalah reaksi substitusi, terjadi pergantian gugus OH digantikan gugus Cl.
Reaksi III adalah reaksi eliminasi, terjadi pengubahan ikatan tunggal menjadi ikatan rangkap dan melepaskan gugus Cl dan H menjadi HCl.
Jadi jawaban yang tepat C.
Soal nomor 40:
Perhatikan data berikut! 1 – 3
| No | Kation Logam | Anion Nonlogam | Rumus Kimia | Nama Senyawa |
| (1) | Na+ | NO3– | Na3NO | Natrium Nitrat |
| (2) | K+ | SO42– | K2SO4 | Kalium sulfat |
| (3) | Mg2+ | PO43– | Mg2(PO4)3 | Magnesium fosfat |
| (4) | Al3+ | CO32– | Al2(CO3)3 | Aluminium Karbonat |
- 1 dan 2
- 1 dan 3
- 2 dan 3
- 2 dan 4
- 3 dan 4
| No | Kation Logam | Anion Nonlogam | Rumus Kimia | Nama Senyawa |
| (1) | Na+ | NO3– | NaNO3 | Natrium Nitrat |
| (2) | K+ | SO42– | K2SO4 | Kalium sulfat |
| (3) | Mg2+ | PO43– | Mg3(PO4)2 | Magnesium fosfat |
| (4) | Al3+ | CO32– | Al2(CO3)3 | Aluminium Karbonat |
Sumber : diunduh/copy dari www.urip.info dan dipulikasi ulang

























Tidak ada komentar:
Posting Komentar